薬物血中濃度モニタリング(TDM)について
(元香川大学医学部附属病院薬剤部)
元日本大学薬学部教授
福岡憲泰
1)はじめに
薬剤師の職能を発揮できる業務の1つに薬物血中濃度モニタリング(TDM)があげられます。しかしながらTDMの基礎研究に関する報告は多いものの、はたして臨床業務にTDMが十分に活用されているかということには疑問が持たれます。実際、人手の問題や薬剤管理料が限られていることによる採算性やTDMは理解し難いものと思われがちであることなどの理由からTDMが特定の施設に限られて行われている現実は否定できません。
薬剤師は大学で薬物動態学を学びますが、多くの薬剤師がTDMは業務に関係ないと思われるかも知れません。しかしながら、添付文書に「薬物動態」の項が設けられたことからも示されるように薬物治療において効き目の理論的な裏付けには体内での薬物動態理論が不可欠であると思います。そして薬剤師にとって薬物動態の基本的な考え方を理解することは日常業務における服薬指導を説得力のあるものにすると考えます。薬物動態はどうしても難しい理論や数式が先行することが多いので、理解する前に嫌気がさしてしまうことが多いように思われます。私は幸いにも大学病院ではTDMを勉強し、実践する機会に恵まれてきました。自分なりに理解しているTDMをわかりやすく説明することができればと思います。
2)血中の薬物濃度測定
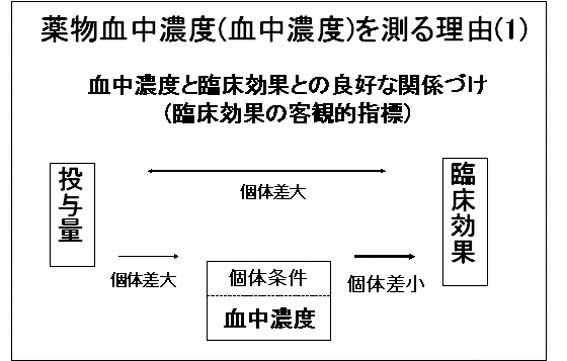
TDMは薬物の血中濃度を測ることから始まりますが、「なぜ薬物の血液中の濃度を測るのか」ということについて説明致します。まず、1つの理由として薬物の効果を調べるときに投薬量よりも血中濃度を用いた方が、よりわかりやすいということです。(図参照)
私はTDMについて考えるとき、一番身近な薬であるアルコール(お酒)を引き合いに出すことにしています。例えばコップ1杯のビール(という投薬量)から得られる酔いの程度(薬理効果)は人様々であることはよくご存じのことでしょう。このことは投薬量をもとにして効果は推測しにくいということの実例です。一方、アルコールの血中濃度をもとにして酔いの程度を判断していることが身近にあります。それは飲酒運転の検問で行う呼気中アルコール量の測定です。これは呼気中のアルコール量が血液中のそれをよく反映することによります。そして血液中のアルコール量が同じであれば酔い方もほぼ同じであるという考え方にもとづいて酒気帯びに代表されるような酔い方の程度を客観的に判断することができます。
以上のように緩和な作用を持つアルコールにおいても血液中濃度から効果を考えた方がわかりやすいですから、もっと強力な薬理作用を持ち厳密な血液中濃度が求められる薬物ではなおさらのことと理解してもらえるでしょう。
次に効果を考えたとき、効果の現れる組織(標的臓器)での薬物濃度が薬理作用と強く相関することがわかっています。1つの例として、抗てんかん薬の脳内濃度とけいれん抑制効果との関係があげられます。しかしながら、標的臓器内の薬物濃度を測ることは臨床的にはできません。このことからもう1つの理由として、血中の薬物濃度を測ることで標的臓器内の薬物濃度を推定し効果と関係づけようということがあげられます。(図参照)
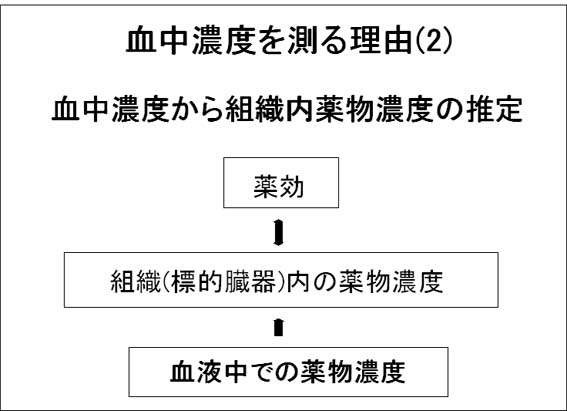
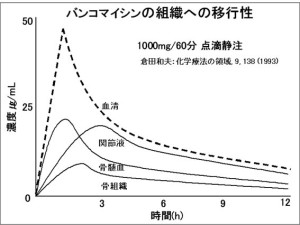
このとき、両者の濃度が一様に変化すればわかりやすいのですが、薬物によっては複雑に変化するものもあります。代表的な例として抗MRSA薬のバンコマイシンについて示します。(図参照)このようなときに血中濃度から各組織内の濃度を推定するにあたって、特に薬物の体内動態の考え方が必要となります。そして体内動態をわかりやすくするためにコンパートメントモデルや速度定数などの概念も登場してきます。
3)体内動態のモデル
組織内の薬物濃度と臨床効果はよく相関しますが、濃度が時間とともに変わりますので効果を考えるときにはどうしても時間に影響されることになります。ここで両方の濃度が時間とともに一様に変わればわかりやすいのですが、薬物によってはそうならないものもあります。
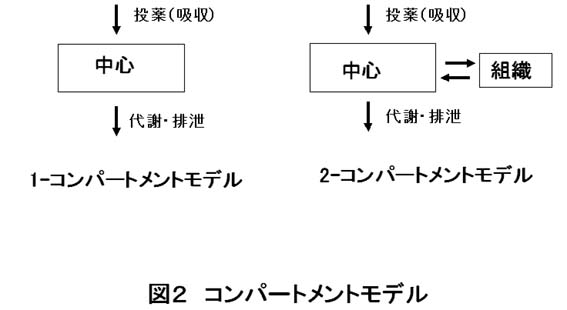
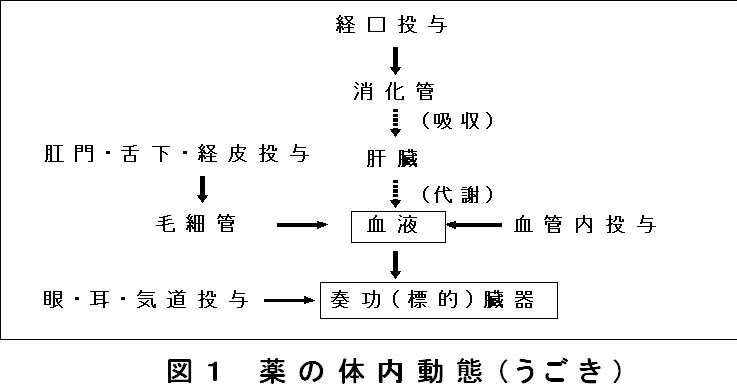
2回目の今回は人体を単純なモデルに置き換えて濃度変化を考えることについて示します。血液中の薬物濃度は、薬物が図1のように様々な方法で投与されたのちに血液中に達することで上昇し、その後に臓器へ分布し、さらに代謝、排泄されることで低下します。
このときの血液中の濃度から臓器中の濃度を推定するのにコンパートメントモデル(図2)が使われます。コンパートメントとは「仕切り」とか「区切り」あるいは「客車」という意味で、コンパートメントモデルとは「人体を簡略化したモデルであらわし、コンパートメント間の物質移動として速度定数で結ぶ理論体系」と記されています。大学で習い、国試のための計算問題を解いた方が多いと思います。代表的なものとして1-コンパートメントモデルは血液と組織の濃度が一様に変わる場合、2-コンパートメントモデルは両者の濃度変化に乖離がある場合と説明されています。
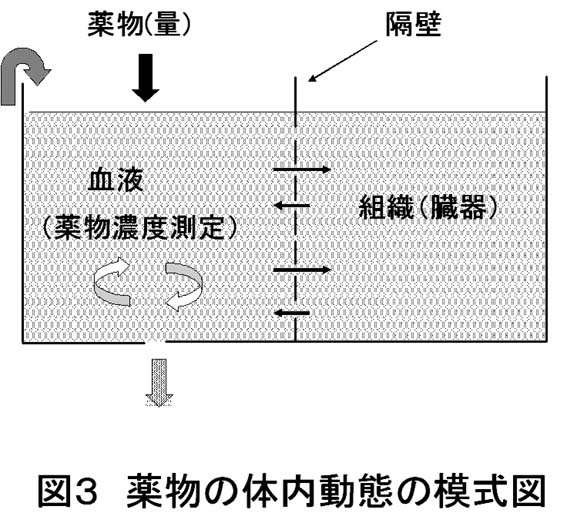
しかし、これだけでは多分理解しにくいのではないでしょうか。そこで、図3に示すような水槽を思い浮かべてください。
水槽は隔壁で左右に分けられ隔壁には穴が開いています。そして左半分は常に撹拌されており、下の穴からは常に水が抜けて、抜けた水量と同じ量の水が左側に入り水槽全体の水量は常に一定に保たれています。ここで、左側に薬物の代わりに塩を入れ塩水を作ることを想像して下さい。このとき右側の水槽の塩分濃度を知りたいのですが、左側の塩分濃度しか測ることができないとき、どのようにして左の塩分濃度から右の濃度を推測するかということになります。あくまで私の考え方なので正しく表せていないかもしれませんが、以上のような考え方をすれば薬物の体内動態についてコンパートメントモデルを用いる理由が理解しやすくなるのではないかと思います。
図3とコンパートメントモデルを対応させますと、左側の水槽が血流によって高速に撹拌(循環)されている血液(中心)コンパートメントで、右側が組織(臓器)コンパートメントになります。そして両方の槽は濃度勾配等による薬物の移動があり、その移動は速度定数で関係づけられます。また、溶かす薬物の単位は重さ(量)ですが濃度として測られますので体積で割られることになります。この体積である水量が分布容積に対応します。また、左の下から抜ける水量はクリアランスとして考えることができます。
さらに1-コンパートメントと2-コンパートメントモデルの違いについては次のように考えることができます。左右に分ける隔壁の穴が大きく薬物が移動しやすいとき(実際の移動には穴の大きさだけでなく、薬物の物性なども影響します)、塩を例にとりますと隔壁の穴が大きくて左側に溶かした後、非常に速やかに右側の槽との塩分濃度比が均一になる(必ずしも同じにはなりません)ことは想像できますが、このような挙動を示す薬物が1-コンパートメントモデルで近似できます。一方、隔壁の穴が小さく左側と右側の濃度比が均一になるのに時間がかかるような場合が2-コンパートメントモデルで近似できる薬物で、代表的なものとしてジゴキシンがあげられます。
4)吸収・分布・代謝・排泄
体内での薬物の濃度推移を考えるときに、「吸収・分布・代謝・排泄」の各過程について知ることが重要です。薬物の体内動態を考えるとき、「吸収・分布・代謝・排泄」は体が薬物にはたらきかける面ですが、当然はたらきをうける側の薬物はその性質(以下、物性と記しますが特に水溶性か脂溶性かについて着目します)によって各過程で違った「うごき」をします。したがって、薬物の体内動態を薬物の物性によって区別して説明したいと思います。
1 .吸収過程
内服した薬物は血液中に移行するまでに消化管での吸収と肝での初回通過をうけますが、このことが薬物濃度を決める要因になります。内服後の薬物は消化管から吸収されますが、消化管は脂質二分子膜であることから、脂溶性の高い薬物ほど吸収されやすく水溶性の高い薬物ほど吸収されにくくなります。水溶性薬物の代表例としてバンコマイシンやアミノ配糖体薬があげられます。これらは血管内投与が中心で消化管から吸収されません。このことから薬物の血中への移行は脂溶性薬物ほど高くなるものと予想されますが、消化管からの吸収後の肝の初回通過の際には脂溶性の高い薬物ほど初回通過効果をうけやすいこと、すなわち失活されやすいことがわかっています。したがって未変化体としての血中移行(bioavailability:生物学的利用率)は物性による差はないと思われます。
薬物が吸収されるとき一般的には消化管内の薬物量が多いほど多く吸収されること、すなわち吸収速度が一次過程に従うことと定義されています。吸収を考えるときに役立つパラメータとして「最高濃度到達時間」があります。これによって効果の発現時期を予測することができます。
2.分布過程
吸収、肝初回通過後の薬物は血流によって全身組織に分布します。(静脈内注射など血管内に直接投与する場合はこの過程から始まります。)この過程においては分布容積というパラメータが用いられます。実際にわかっているものは投薬量と測定された血中濃度になります。したがって、体の中でよくわからないが薬物が行き渡っている部分の体積を仮定し、投薬量と血中濃度を関係づけるパラメータとして分布容積が推定されます。あくまで仮定ですので“見かけの”という言葉も使われます。ここで分布容積中の薬物濃度は均一であることと仮定され「分布容積=体内薬物量/血中濃度」で定義されます。体積がわからない器に入っている水の量を調べるのに塩を溶かして塩水の濃度をはかることと同じようなことです。
体内への分布については、脂溶性の高い薬物は組織に移行しやすく、一方水溶性の高い薬物は組織に移行しにくい。したがって同じ投薬量のとき、脂溶性の高い薬物ほどその血中濃度は低くなり、分布容積は大きく見積もられることになります。
3.代謝過程
薬物といえども体にとっては異物ですので、体はできるだけ速やかに体外へ排泄するようはたらきかけます。排泄を担う主な臓器は腎臓ですが、脂溶性の高い薬物は腎臓から排泄されない(糸球体でろ過されても尿細管で再吸収されるため)ので、肝臓でより水溶性の高い代謝物に変化し、腎臓から排泄されるようになります。このとき肝臓で代謝されることが、その薬物にとって体内からの「消失」になります。すなわち脂溶性の高い薬物が肝臓において、より水溶性の高い物質に変化させられることが「代謝」といえます。この反応には酸化・還元・加水分解される第一相、グルクロン酸・硫酸抱合やアセチル化される第二相があります。
肝臓で代謝される薬物は、それぞれどの代謝酵素で代謝されるかが決まっています。したがって、代謝阻害や酵素誘導といった代謝に関連した相互作用、いわゆる「のみあわせ」といった他の薬物との併用による効果の増強や減弱が懸念されます。
4.排泄過程
薬物が排泄される主な臓器は肝臓と腎臓です。肝臓では脂溶性の高い薬物が胆汁中へ、腎臓では水溶性の高い薬物が尿中へ排泄されます。これらの排泄がそれぞれの薬物にとって「消失」になります。排泄過程とあわせて体内からの薬物の消失は代謝と排泄によって行われます。
消失についても吸収と同様に一次速度過程が成立するので、体内薬物量に比例して消失します。つまり“体の中に薬がたくさんあるほど、たくさん消失”することになります。臨床でもっとも頻繁に用いられるパラメータの一つに「消失半減期」があります。「半減期」という語句で用いられていますが、本来の意味から「消失半減期」といってほしいと思います。これは薬物濃度が半分に減少するまでに要する時間で、体内から薬物が消失する速度の目安になります。一方で、くり返し投薬したときの蓄積の目安にもなります。のみ続けていた薬を止めたときに体内から薬がほとんど消失するのに要する時間、および新たに薬をのみ始めたときに血中濃度が定常状態になるのに要する時間が消失半減期の4~5倍になることがわかっていますので、服薬指導などに用いることができる有用なパラメータとなります。
5)解析ソフトによる実例
前節までは薬物の体内動態について理論的な内容を中心に進めてまいりました。今回は実際の臨床の場でTDMがどのように活用されているかについて示します。
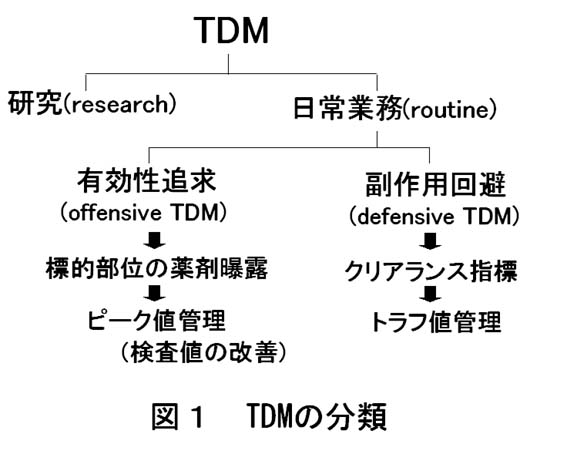
臨床での目的を考えると、TDMは図1のように分類されると考えられます。TDMの業務内容は有効性の追求と副作用の回避に分けることができますが、現実的な対応としてはピーク濃度とトラフ(次回投与直前)濃度の管理になるのではないかと思います。
有効性の追求と副作用回避への対応は、前者が投薬の増量、後者が減量というようにある意味では相反することもあります。しかし、臨床では両者を満足するような投与設計が求められることが多くあり、その代表例として院内感染対策における抗生物質の投与設計があげられます
抗生物質はその作用機序から、求められる血中濃度の推移が異なります。例えばアミノ配糖体であるハベカシンでは投与終了後のピーク値が、グリコペプチドであるバンコマイシン、テイコプラニンでは有効とされる濃度がどれくらいの時間維持されるかというようなことが有効性の指標になります。その一方でこれらの薬物はほとんどが腎臓から排泄されますので、腎臓に障害がある場合の投薬では排泄が滞ることを考慮した適切な投与設計が副作用の回避として求められます。
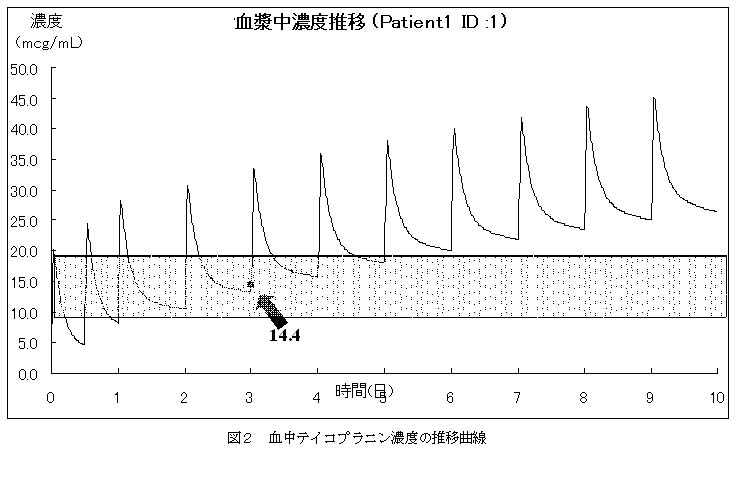
投与設計を行うには、薬物の処理能力などを個別に求めることが必要になります。ここで、前回までにお話してきたような「からだの中での薬のうごき」を制御する各パラメータの値が1回の採血結果をもとにして概ね定量的に捉えることができます。簡単に言うと、「からだの中での薬のうごき」を時間と血中濃度の関係としてグラフに表すことができます。(図2)
図2に示す患者様は、67歳女性で体重67.5kg、血清中クレアチニン値が2.7mg/dLで喀痰中からMRSA(メチシリン耐性黄色ブドウ球菌)が検出されました。その結果、抗MRSA薬テイコプラニン(TEIC)を1日目に200mg/時間の点滴静注を2回、以降1日1回ずつくり返し、3日目の投与前に血中濃度を測りました。その時の濃度は14.4μg/mLでした。この薬剤の治療濃度域はトラフ濃度として10~20μg/mLが推奨されています。したがってこの時点では問題なく十分な治療効果が期待できるものと思われますが、グラフをみると同量投与をくり返すことで濃度が上昇し続けることがわかります。このことから、現状の投与方法をくり返すことで副作用の発生が懸念されることになります。しかし、医師からは治療効果が認められるので、この薬剤を継続投与したいという要望がありました。
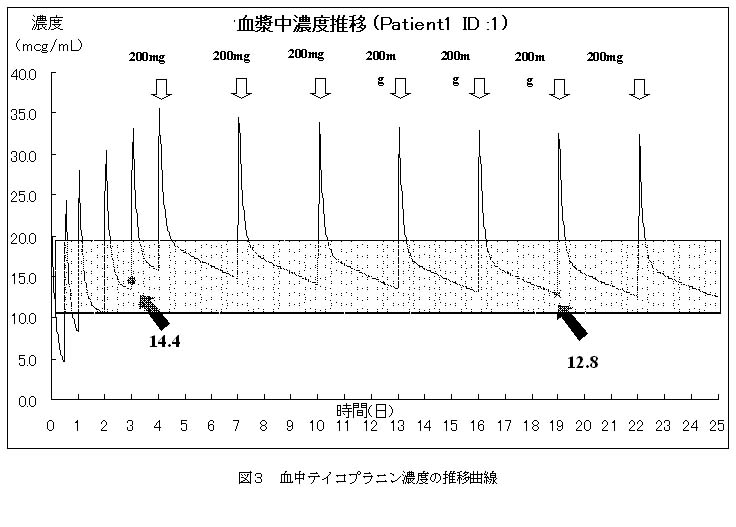
以上のことから、この場合の対応としては、副作用がなく、しかもトラフ濃度が治療域内を推移するような投与設計が求められることになります。ここで、薬物と患者様の固体情報それぞれについて考えてみます。まず、TEICはそのほとんどが腎臓から排泄されるものであること、そして血清中クレアチニン値が2.7mg/dLである患者様においては腎臓からのTEIC排泄能が低下しているものと考えられます。したがって低下した腎機能に応じた投与設計として投薬の減量が求められます。ここでテイコプラニンでは有効とされる濃度がどれくらいの時間維持されるかということが効果にとって重要で、高いピーク濃度は要らないことを併せ考えると、1日あたりの投薬量を減らせばよいことになります。しかし注射薬の場合、1バイアル量を小分けして用いることは経済的ではありませんので、できれば1バイアル量単位の投与が経済的です。このとき腎機能が低下している場合の投与設計には投与間隔をあけてトラフ値が治療濃度域まで低下してから次の投薬を行う方法がありますので、これにもとづく濃度推移の予想を図3に示します。
図3には1バイアル量200mgを3日に1回ずつ投与したときの濃度推移の予測です。この患者様の腎臓からのTEICの排泄を考慮すると、3日あたり200mgの投薬量が望ましいことがわかります。
ところで、ある1点の血中濃度をもとにその後の濃度推移を予測し投薬量を決定することは非常に有用なことです。しかしながら、このことはあくまでも1点の血中濃度にもとづく数学的な次元での予測です。したがって、採血の時刻が違っていたり、投与変更によって患者様での薬物体内動態が変わることも予想されます。このことから、投薬量の変更後には再度血中濃度を測定して予測濃度に近い濃度が得られていることを確認することが必要です。これによって1点の血中濃度が正しい情報をもたらすこと、さらには薬物動態が変動していないことも確認できます。この患者様においては変更2週間後の測定で12.8μg/mLの濃度が確認され、その3日後にMRSAの消失が認められました。
今日では台風が発生したときに、ある時刻をもって北緯…度、東経…度の位置が示され、それとともに予想進路が予報円として示されるのはご承知のとおりです。これによってあらかじめいろいろな準備ができ、災害を未然に防ぐことができます。これと同じように特定時刻の濃度測定値をもとに薬物動態学によってそれ以降の薬物濃度の推移を予測し、効果と関係づけることや投与設計ができることはTDMの臨床における大きな威力となります。
6)解析ソフトによらない実例
前節では解析ソフトを用いての投与設計を紹介しましたが、今回は解析ソフトを使わなくてもできるもので、かつ濃度測定を必ずしも自分の施設で行わなくても投与設計ができるような臨床実例を紹介致します。
TDMはまず初めに薬物の血中濃度を測定することから始まりますが、ほとんどの施設あるいは薬局において濃度の測定は行われていないと思われます。しかし、TDMの本来の目的は「測定結果にもとづいて投与設計を変更すること、服薬を遵守するよう患者にはたらきかけること」であり、必ずしも測定は求められていません。したがって、結果に対して臨床的に望ましい解釈をすることがTDMの目的と言えます。実際には外注結果を利用することになろうかと思いますが、結果がわかるまで時間がかかることは避けられません。このような状況ではすべての薬物についてTDMによる投与設計を行うのは現実的ではないかもしれません。
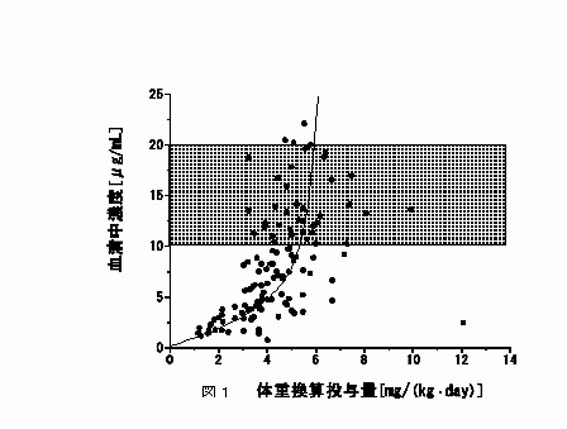
測定を行っていない場合でもTDMを実施するに望ましく、しかも臨床的に有意義な薬物の1つに外来患者でのフェニトイン(PHT)に対する投与設計があげられます。その理由は2つあり、1つは外来患者では比較的安定した薬物療法が行われているので、投与設計に比較的時間の余裕があることです。入院患者では病状が大きく変わることや量を検討しながら投薬していることが多いことから、測定結果や解析結果がわかるのに時間をかけられないことが多く、この結果、測定結果の解釈をする前に投与量の変更や中止をすることがしばしば見うけられます。もう1つの理由はPHTの動態学的な特徴です。ほとんどの薬物は「線形性」と呼ばれる動態を示します。「線形性」とは定常状態における「血中濃度(一般にはトラフ値)と1日投薬量とが比例すること」です。このときの投与量の変更は目標血中濃度との比例関係から求めることができます。一方、PHTでは「非線形性」の動態を示します。肝で代謝される薬物の中には、肝での代謝能力に限界があるために飽和現象が現れ、ある濃度以上になると血中濃度が急上昇するものがあります。代表的な薬物にフェニトイン、アプリンジンがあげられます。図1は香川大学病院の測定データですが、ここに示すように投与量と濃度の関係を示す回帰線が直線でないことから両者が正比例しないことがわかります。投与量が0~4 mg/kg/dayまで(濃度は0~6もしくは8 µg/mLまで)はほぼ直線関係、それ以降は少しの増量で濃度が急激に上昇することがわかります。したがって、治療濃度域(10~20µg/mL:斜線部)においては投与量をちょっと増やすだけで濃度が大きく上昇することがわかります。
PHTでは常用量と肝代謝酵素の飽和量が接近しているので、有害事象の発生がしばしばみられます。肝代謝酵素の飽和量(Vmax (mg/kg/day))は体重あたりの量として示されることから、体重とともに変動することが予想されます。したがって体重が減ることでかつての維持量がVmaxに近づき、その結果、濃度が大きく上昇することが予想されます。
今回示す患者は、体重減少によってかつての至適維持投与量が過量となった結果、TDMで至適投与量を設定することが必要になりました。患者は37歳、体重60kgの男性で症候性部分てんかんのためPHT(アレビアチン®散) 200mg 朝服用し、血中濃度は15 µg/mL で十分な臨床効果が維持されていました。しかし、体重が1ヶ月間に5kg減少し、微弱ではありましたが副作用と考えられる症状が認められました。外来受診時の採血で、19.0 µg/mL のPHT濃度が認められたので、もとの濃度である15 µg/mLにまで下がる維持量を推定することになりました。
PHTの動態は式(1)によって解析できます。
体重あたりの1日量 (mg/kg/day) = Vmax × Css / ( Km + Css ) (1)
Css:定常状態のPHT血中濃度(µg/mL) Km:ミカエリス定数(µg/mL)
この場合、体重の変動(60kg → 55kg)に伴う2つの濃度(15.0 → 19.0)がありますので、これを式(1)に代入し以下の連立式 ①と②からVmaxとKmを求めることができます。
3.33 ( : 200÷60) = Vmax × 15 / ( Km + 15 ) … ①
3.64 ( : 200÷55) = Vmax × 19 / ( Km + 19 ) … ②
以上から、 Vmax = 5.73 mg/kg/day、 Km = 10.9 µg/mL が得られます。
そして、PHTの1日投与量は式(1)で得られた量に体重 55kg をかけて求めることができます。
体重あたりの1日量 (mg/kg/day) = 5.73 × 15 / ( 10.9 + 15 ) = 3.32
1日投与量(mg/day)= 3.32×55 = 182.6
この結果、180mg/dayに減量することになり、その後、副作用と思われる症状は消滅し、次回の受診日におけるPHT濃度が14.3 µg/mLであったことから、投与設計が妥当なものであったことを確認しました。
今回のように採血結果が2つ以上あれば、未知数としてのVmax とKmを連立方程式の解として求めることができます。しかし、採血点が1つしかなくてもベイジアン法を用いて高い精度で求めることのできる解析ソフトがありますので、それを用いることで十分な臨床対応ができます。いずれにせよ、理論的に投薬量を推定することは臨床的に非常に有意義です。そうでなければ10mg程度で漸減していくことになり、効率の悪い治療にならざるを得ません。
薬剤師は薬物動態論について十分な知識を持っています。したがって、添付文書に記載されている動態パラメータをもとに薬物療法について理論的に考えることができるはずです。血中の薬物濃度を測らなくても、動態学の理論を日常業務に応用することで、よりよい薬物療法を推進できるものと考えます。